Eficacia de la vacuna

La imagen corresponde a modelos, no corresponde a pacientes reales.
GARDASIL® 9 [Vacuna recombinante nonavalente contra el virus del papiloma humano], eficacia demostrada contra ciertos cánceres y enfermedades relacionadas con el VPH.1
La eficacia de GARDASIL® 9 en contra de infecciones y enfermedades relacionadas con VPH tipos, 6, 11, 16 y 18 fue inferida de estudios comparativos con GARDASIL® [Vacuna recombinante tetravalente contra el virus del papiloma humano (Tipos 6,11, 16,18)]; en los que GARDASIL® 9 provocó una respuesta inmune medida por Títulos Medios Geométricos (GMT, por sus siglas en inglés).1
Estos estudios fueron diseñados para evaluar la no inferioridad inmunológica de GARDASIL® 9, en comparación con GARDASIL®. Por lo tanto, los hallazgos del estudio pivotal de eficacia para GARDASIL® en comparación con los tipos 6, 11, 16 y 18 de VPH y enfermedades relacionadas, fueron extendidos a GARDASIL® 9; demostrando que la respuesta inmune lograda no fue inferior a la respuesta inmune alcanzada por GARDASIL®.
Resumen de ensayos clínicos:
La eficacia de GARDASIL® 9 fue evaluada en 6 estudios clínicos con distribución al azar, doble ciego controlados con placebo, evaluando 28,413 individuos (20,541 niñas y mujeres de 16 a 26 años y 4,055 niños y hombres de 16 a 26 años al momento de iniciar el estudio). La eficacia se evaluó en sujetos que recibieron las 3 dosis en el plazo de 1 año después de la inscripción, no tuvieron desviaciones importantes del protocolo del estudio y no tenían exposición previa a los tipos de VPH relevantes antes de la 1a dosis y hasta 1 mes después de la dosis 3 (mes 7).

AIN = Neoplasia intraepitelial anal; AIS = Adenocarcinoma cervical in situ; CIN = Neoplasia intraepitelial cervical; GMT = Títulos medios geométricos; PCR = Reacción en cadena de la polimerasa; VaIN = Neoplasia intraepitelial vaginal; VIN = Neoplasia intraepitelial vulvar; VPH = Virus del papiloma humano
GARDASIL® 9 [Vacuna recombinante nonavalente contra el virus del papiloma humano] ha demostrado protección contra ciertos cánceres y enfermedades, relacionados con el VPH.1
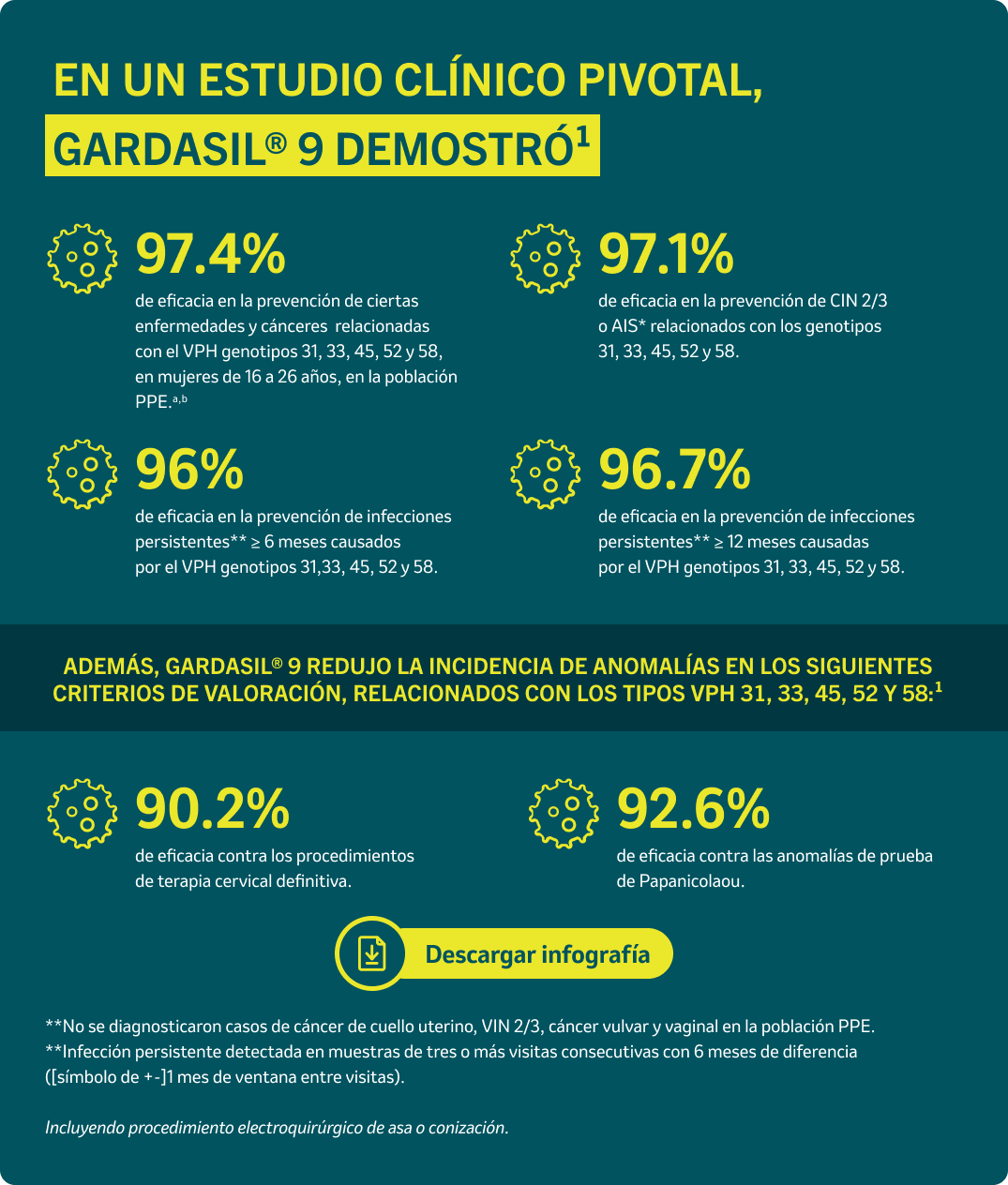
aBasado en la población por protocolo de eficacia (PPE), que consistió en individuos que recibieron las 3 vacunas durante 1 año desde la inscripción, no tuvieron desviaciones importantes del protocolo del estudio, y sin exposición previa (PCR negativa y seronegativa) a los tipos relevantes de VPH (Tipo 31, 33, 45, 52 y 58) antes
de la 1ª dosis y que siguieron presentando PCR negativa al tipo o tipos de VPH relevantes, hasta 1 mes después de la 3ª dosis (mes 7).
bLa eficacia de GARDASIL® 9 en mujeres de 16 a 26 años de edad se evaluó en un estudio clínico con distribución al azar, doble ciego, controlado con comparador activo
que incluyó un total de 14,204 mujeres (GARDASIL® 9 = 7,099, GARDASIL® = 7,105), que se inscribieron y se vacunaron sin revisión previa para detectar la presencia
de una infección por VPH. Se dio seguimiento a las pacientes hasta 67 meses después de la 3ª dosis, con una duración media de 43 meses.
AIN = Neoplasia intraepitelial anal; AIS = Adenocarcinoma cervical situ; CIN = Neoplasia intraepitelial cervical; GMT = Títulos medios geométricos; PCR = Reacción en cadena de la polimerasa; PPE = Población por protocolo de eficacia; VaIN = Neoplasia intraepitelial vaginal; VIN = Neoplasia intraepitelial vulvar; VPH = Virus del papiloma humano
Administre GARDASIL® 9 por vía intramuscular en el área deltoidea o anterolateral del muslo. Para GARDASIL® 9, un régimen completo de vacunación consiste en:
- Para personas de 9 a 14 años de edad, GARDASIL® 9 se puede administrar en un programa de 2 o 3 dosis. Para el programa de 2 dosis, la segunda dosis debe administrarse de 6 a 12 meses después de la primera dosis. Si la segunda dosis se administra menos de 5 meses después de la primera dosis, se debe administrar una tercera dosis al menos 4 meses después de la segunda dosis. Para el esquema de 3 dosis, GARDASIL® 9 debe administrarse a los 0, 2 y 6 meses.
- Para personas de 15 a 45 años de edad, GARDASIL® 9 se administra en un programa de 3 dosis a los 0, 2 y 6 meses.
Descubre más contenido que podría interesarte
Referencias
- Información para prescribir de GARDASIL® 9 [Vacuna recombinante nonavalente contra el virus del papiloma humano]


