

KEYTRUDA, en combinación con quimioterapia con o sin bevacizumab, está indicado para el tratamiento de pacientes con cáncer de cérvix persistente, recurrente o metastásico en mujeres adultas cuyos tumores expresen PD-L1 con una CPS ≥ 1.
- Indicación
- Diseño del estudio
-
Características de las
pacientes - Eficacia
- Biomarcación
- Tolerabilidad
- Dosis
- Resumen
-
Abreviaturas
y Referencias

Supervivencia Global (OS) Superior:
- En un estudio de fase 3, KEYTRUDA + quimioterapiaa ± bevacizumab redujo el riesgo de muerte en un 40% vs. placebo + quimioterapiaa ± bevacizumab2 (HRb=0.60; IC del 95%,0.49–0.74; Pc=0.0001), en la población que expresa un PD-L1 CPS >= 11,2
- La mediana de OS fue de 28.6 meses para KEYTRUDA + quimioterapiaa ± bevacizumab (IC del 95%, 22.1-38.0) vs. 16.5 meses con placebo + quimioterapiaa ± bevacizumab (IC del 95%, 14.5-20)1,2 en la población que expresa un PD-L1 CPS ≥ 1.
a Quimioterapia: paclitaxel y cisplatino o paclitaxel y carboplatino.
b Basado en el modelo de riesgo proporcional estratificado de Cox.
c Basado en una prueba estratificada de orden logarítmico (en comparación con un límite alfa de 0.00491).
Información Seleccionada de Seguridad – KEYTRUDA®
UN ESTUDIO DE FASE 3 DE KEYTRUDA + QUIMIOTERAPIA ± BEVACIZUMAB PARA EL TRATAMIENTO DEL CÁNCER CERVICOUTERINO PERSISTENTE, RECURRENTE O METASTÁSICO EN PRIMERA LÍNEA1
KEYNOTE-826: un estudio de fase 3, multicéntrico, distribuido al azar, doble ciego, controlado con placebo, que inscribió a 617 pacientes1
KEYNOTE-826: Diseño del estudio1
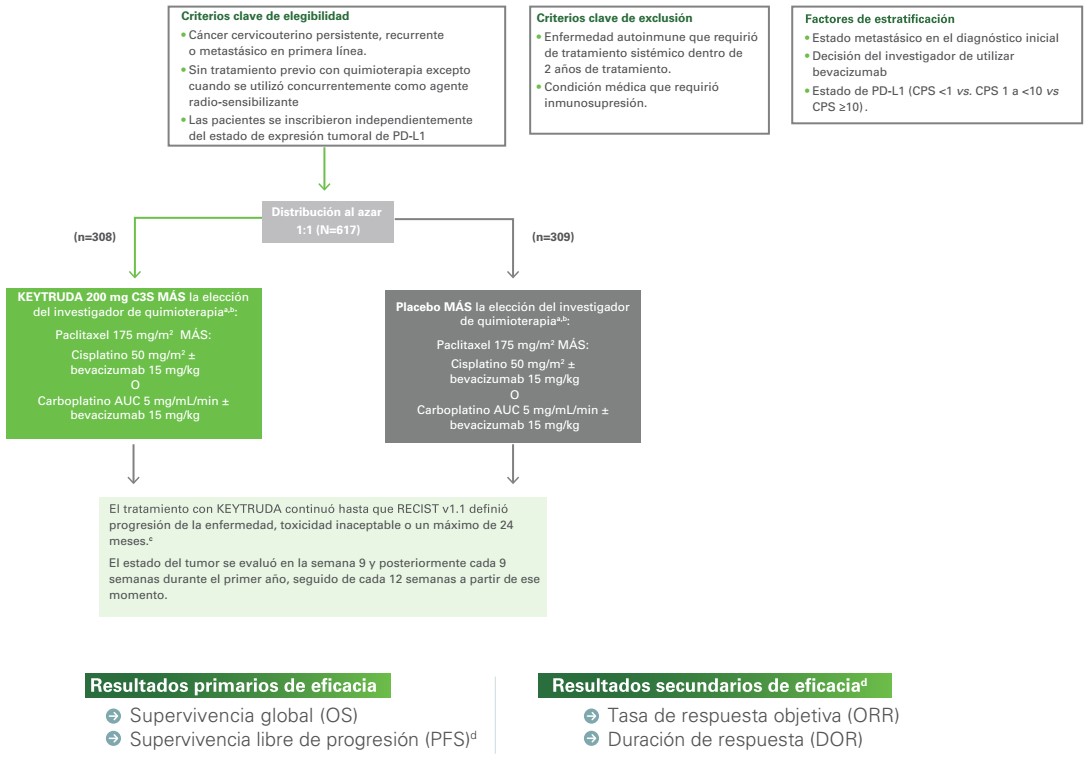
a Todos los medicamentos del estudio se administraron como una infusión intravenosa.
b Todos los tratamientos del estudio se administraron el día 1 de cada ciclo de tratamiento de 3 semanas. El cisplatino podría administrarse el día 2 de cada ciclo de tratamiento de 3 semanas.
c Se permitió la administración de KEYTRUDA más allá de la progresión de la enfermedad definida por RECIST si la paciente estaba clínicamente estable y el investigador consideraba que obtenía un beneficio clínico.
d Según lo evaluado por el investigador de acuerdo con RECIST v1.1.
Información para Prescribir completa – KEYTRUDA®
Información Seleccionada de Seguridad completa – KEYTRUDA®
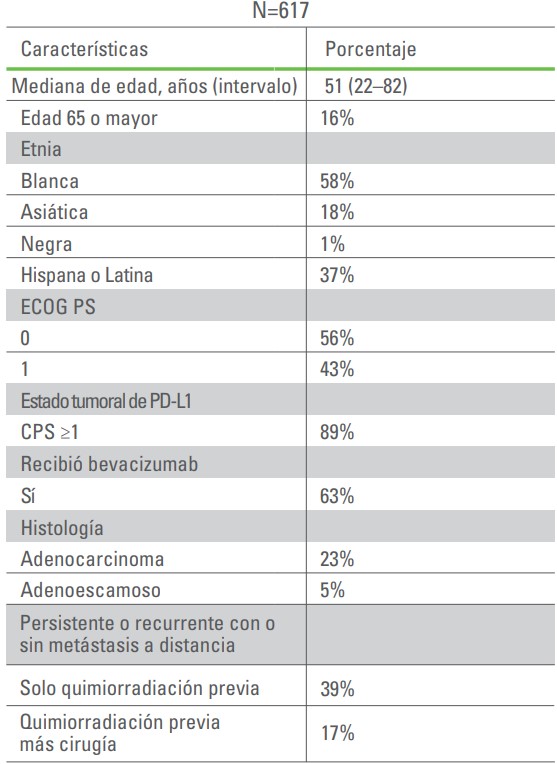
KEYNOTE-826: CARACTERÍSTICAS INICIALES DE LAS PACIENTES ESTUDIADAS
KEYTRUDA, en combinación con quimioterapia, con o sin bevacizumab, esta indicado para el tratamiento de pacientes con cáncer de cérvix persistente, recurrente o metastásico en mujeres adultas cuyos tumores expresan PD-L1 con una CPS ≥1.1

Características iniciales de las participantes del estudio1
Información para Prescribir completa – KEYTRUDA®
Información Seleccionada de Seguridad completa – KEYTRUDA®
Posibles reacciones adversas inmunomediadas:
Neumonitis, colitis, hepatitis, nefritis, endocrinopatías (insuficiencia suprarrenal [primaria y secundaria], diabetes mellitus tipo 1, incluida cetoacidosis diabética), trastornos de la tiroides, incluidos hipertiroidismo, hipotiroidismo y tiroiditis, reacciones cutáneas severas, incluyendo síndrome de Stevens-Johnson (SJS) y necrólisis epidérmica tóxica (TEN).
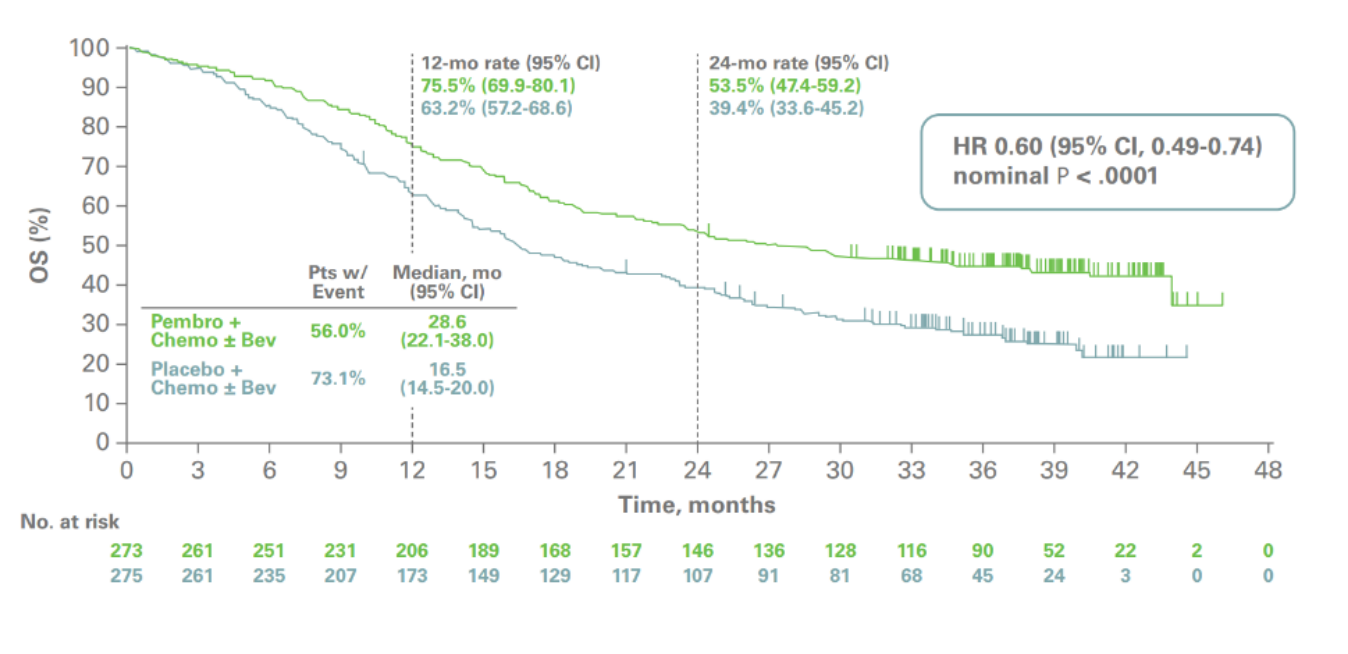
SUPERVIVENCIA GLOBAL
KEYTRUDA + QUIMIOTERAPIA ± BEVACIZUMAB DEMOSTRÓ UNA OS SUPERIOR VS. PLACEBO + QUIMIOTERAPIA ± BEVACIZUMAB EN PACIENTES CUYOS TUMORES EXPRESAN PD-L1 (CPS ≥1)1,2
Curva de Kaplan-Meier para Supervivencia Global en el KEYNOTE-826 (CPS ≥1)1
Supervivencia Global (OS ) Superior:1
En el KEYNOTE-826, se observó una reducción del 36% en el riesgo de muerte con KEYTRUDA + quimioterapiaa ± bevacizumab vs. placebo + quimioterapiaa ± bevacizumab en la población con CPS ≥1 (HRb =0.64; IC del 95%, 0.50–0.81; P c=0.0001)1,2
Número de pacientes con un evento: 118/273 (43.2%) con KEYTRUDA + quimioterapiaa ± bevacizumab vs. 154/275 (56.0%) con placebo + quimioterapiaa ± bevacizumab1,2
No se alcanzó la mediana de OS (IC del 95%, 19.8–NR) con KEYTRUDA + quimioterapiaa ± bevacizumab vs. una mediana de OS de 16.3 meses (IC del 95%, 14.5–19.4) con placebo + quimioterapiaa ± bevacizumab1,2
a Quimioterapia (paclitaxel y cisplatino o paclitaxel y carboplatino).1
b Basado en el modelo de riesgo proporcional estratificado de Cox.1
c El valor P (unilateral) se compara con el alfa asignado de 0.0055 para este análisis interino (con el 72% del número planificado de eventos para el análisis final).1
SUPERVIVENCIA LIBRE DE PROGRESIÓN
KEYTRUDA + QUIMIOTERAPIA ± BEVACIZUMAB DEMOSTRÓ PFS SUPERIOR VS. PLACEBO + QUIMIOTERAPIA ± BEVACIZUMAB EN PACIENTES CUYOS TUMORES EXPRESAN PD-L1 (CPS ≥1)1

Supervivencia Libre de Progresión (PFS) Superior:1
En el KEYNOTE-826, se observó una reducción del 42% en el riesgo de progresión de la enfermedad o muerte con
KEYTRUDA + quimioterapiaa ± bevacizumab vs. placebo + quimioterapiaa ± bevacizumab en pacientes con CPS ≥1 (HRb
=0.58; IC del 95%, 0.47-0.71; P c <0.0001)1,2
La mediana de PFS fue de 10.5 meses (IC del 95%, 9.7–12.3) con KEYTRUDA + quimioterapiaa ± bevacizumab vs. 8.2
meses (IC del 95%, 6.3–8.5) con placebo + quimioterapiaa ± bevacizumab en la población con CPS ≥11
a Quimioterapia (paclitaxel y cisplatino o paclitaxel y carboplatino).1
b Basado en el modelo de riesgo proporcional estratificado de Cox.1
c El valor P (unilateral) se compara con el alfa asignado de 0.0014 para este análisis interino (con el 82% del número planificado de eventos para el análisis final).1
TASA DE RESPUESTA OBJETIVA
KEYTRUDA + QUIMIOTERAPIA ± BEVACIZUMAB DEMOSTRÓ MAYOR TASA DE RESPUESTA OBJETIVA VS. PLACEBO + QUIMIOTERAPIA ± BEVACIZUMAB EN PACIENTES CUYOS TUMORES EXPRESAN PD-L1 (CPS ≥1)1
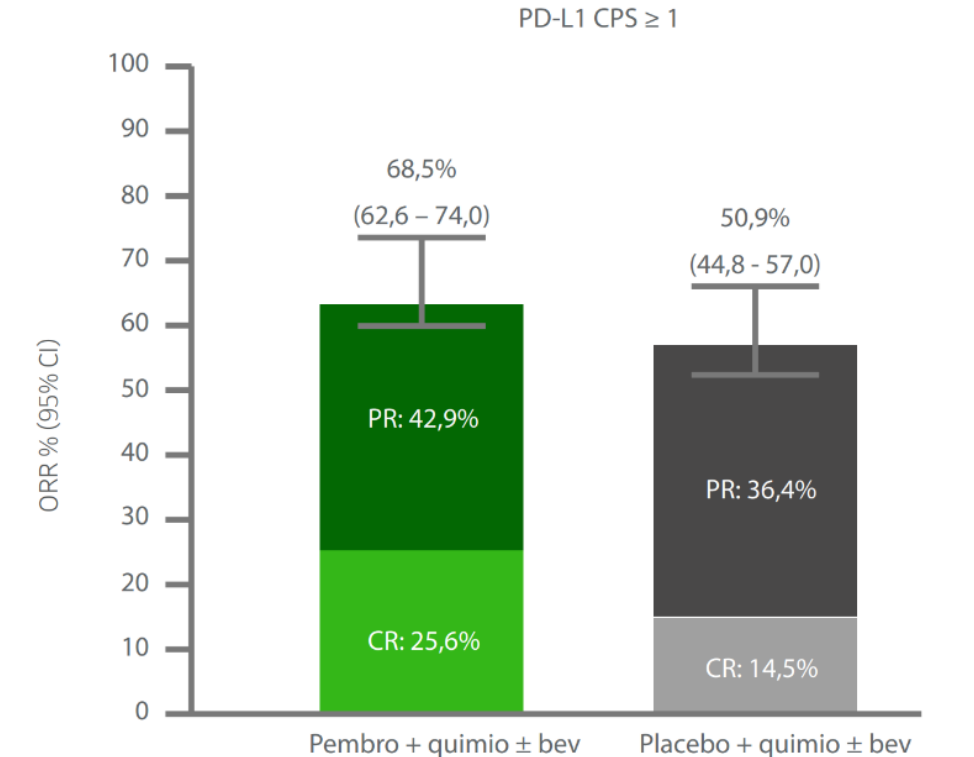
En el KEYNOTE-826, el 68% de las pacientes que expresaron PD-L1 (CPS≥1) lograron una respuesta objetiva con KEYTRUDA + quimioterapiaa ± bevacizumab vs. 50% de las pacientes que recibieron placebo + quimioterapiaa ± bevacizumab.1,2
a Quimioterapia (paclitaxel y cisplatino o paclitaxel y carboplatino).
b Respuesta: Mejor respuesta objetiva como respuesta completa confirmada o respuesta parcial
+ Denota respuesta continua
Información para Prescribir completa – KEYTRUDA®
Información Seleccionada de Seguridad completa – KEYTRUDA®
INFORMACIÓN SELECCIONADA DE SEGURIDAD DE KEYTRUDA
ADVERTENCIAS Y PRECAUCIONES
Reacciones adversas inmunomediadas graves y mortales
Neumonitis inmunomediada
KEYTRUDA® puede causar neumonitis inmunomediada. La incidencia es mayor en pacientes que han recibido radiación torácica previa. Se produjo neumonitis inmunomediada en el 3.4% (94/2,799) de las pacientes que recibieron KEYTRUDA®, incluidas reacciones mortales (0.1%), grado 4 (0.3%), grado 3 (0.9%) y grado 2 (1.3%). Se requirieron corticosteroides sistémicos en el 67% (63/94) de las pacientes. La neumonitis provocó la interrupción permanente de KEYTRUDA® en el 1.3% (36) y la suspensión en el 0.9% (26) de las pacientes. Todos las pacientes a los que se les suspendió, reiniciaron KEYTRUDA® después de la mejoría de los síntomas; de estos, el 23% tuvo recurrencia. La neumonitis se resolvió en el 59% de los 94 pacientes.
Prevalencia de expresión tumoral PD-L1 positiva (CPS ≥1) en el KEYNOTE-826
KEYNOTE-826: KEYTRUDA en combinación con quimioterapia con o sin bevacizumab, está indicado para el tratamiento de pacientes con cáncer de cérvix persistente, recurrente o metastásico en mujeres adultas cuyos tumores expresen PD-L1 con una CPS ≥ 1.
- El estado de PD-L1 (CPS <1 vs. CPS 1 a <10 vs. CPS ≥10) fue uno de los factores utilizados para estratificar la distribución al azar del tratamiento1
- La expresión de PD-L1 se evaluó con el ensayo PD-L1 IHC 22C3 pharmDx y se midió de acuerdo con la CPS.2
EXPRESIÓN TUMORAL DE PD-L1 (CPS ≥ 1) EN EL KEYNOTE-8261,a
89%
(n=548/617) de pacientes inscritos en el KEYNOTE-826 tenían tumores que expresaban PD-L1 con una CPS de ≥ 1
Analice en los pacientes adecuados la expresión tumoral de PD-L1 para determinar la elegibilidad para KEYTRUDA.1
a PD-L1 IHC 22C3 pharmDx es un ensayo inmunohistoquímico que ayuda a identificar pacientes adecuados con ciertos tipos de cáncer, como el cáncer cervicouterino avanzado, para el tratamiento con KEYTRUDA.2,3
El ensayo PD-L1 IHC 22C3 pharmDx respalda el tratamiento personalizado para pacientes con cáncer de cuello uterino persistente, recurrente o metastásico1,3
Expresión de PD-L1 en el cáncer de cuello uterino es determinado por la CPS.3

- La CPS, que incluye células tumorales, linfocitos y macrófagos, se utiliza para evaluar la expresión de PD-L1 en el cáncer de cuello uterino persistente, recurrente o metastásico.1,3
- Aunque el resultado del cálculo de CPS puede superar los 100, la puntuación máxima se define como CPS 100.3
- Se requiere un mínimo de 100 células tumorales viables en el portaobjetos teñido con PD-L1 para que la muestra se considere adecuada para la evaluación de PD-L1.3
La Guía de práctica clínica en oncología de la NCCN (NCCN Guidelines ) para el cáncer cervicouterino recomiendan las pruebas de PD-L1 para pacientes con cáncer de cuello uterino con enfermedad recurrente, progresiva o metastásica.4
Pembrolizumab (KEYTRUDA) en combinación con quimioterapia (cisplatino/paclitaxel o carboplatino/paclitaxel) ± bevacizumab se recomienda como uno de los regímenes combinados preferidos en primera línea para pacientes con cáncer de cuello uterino metastásico o recurrente cuyos tumores expresan a PD-L1 (CPS ≥1) según lo determinado por una prueba validada4,a,b,c,d

Analice a PD-L1 con el ensayo de IHC 22C3 pharmDx o equivalente para determinar la CPS que puede ayudar a identificar qué pacientes con cáncer de cuello uterino avanzado pueden ser elegibles para el tratamiento con KEYTRUDA en combinación con quimioterapia ± evacizumab.1,3
PD-L1 IHC 22C3 pharmDx es un ensayo inmunohistoquímico que ayuda a identificar pacientes adecuadas con ciertos tipos de cáncer, como el cáncer de cuello uterino avanzado, para el tratamiento con KEYTRUDA.3
a Esta recomendación se designa como categoría 1.4
b Intervención preferida = Intervención que se basa en eficacia, tolerabilidad y evidencia superiores; y cuando corresponda la asequibilidad.4
c Categoría 1 = Basado en evidencia de alto nivel, existe un consenso uniforme de la NCCN de que la intervención es apropiada.4
d La NCCN no ofrece garantías de ningún tipo con respecto a su contenido, uso o aplicación y se exime de cualquier responsabilidad por su aplicación o uso de cualquier manera.4
Su Informe del Estado de Biomarcadores Puede Ayudar a Informar El Tratamiento Personalizado de la Paciente con Ciertos Cánceres Cervicouterinos Persistentes, Recurrentes o Metastásicos
Para ciertos cánceres de cuello uterino avanzado, prepare un informe de laboratorio viable que incluya:3

KEYTRUDA en combinación con quimioterapia con o sin bevacizumab, está indicado para el tratamiento de pacientes con cáncer cervicouterino persistente, recurrente o metastásico cuyos tumores expresan PD-L1 (CPS ≥1) determinado mediante una prueba validada.1

Incluya la CPS, que es una evaluación de la expresión tumoral de PD-L1 y la posible elegibilidad para el tratamiento con KEYTRUDA en combinación con quimioterapia con o sin bevacizumab, en su informe de patología para ayudar a informar las decisiones de tratamiento para el cáncer cervicouterino avanzado.1,3
Información para Prescribir completa – KEYTRUDA®
Información Seleccionada de Seguridad completa – KEYTRUDA®
INFORMACIÓN SELECCIONADA DE SEGURIDAD DE KEYTRUDA
ADVERTENCIAS Y PRECAUCIONES
Reacciones adversas inmunomediadas graves y mortales
Colitis inmunomediada
KEYTRUDA® puede causar colitis inmunomediada, que puede presentarse con diarrea. Se ha reportado infección/reactivación por citomegalovirus en pacientes con colitis inmunomediada resistente a corticosteroides. En casos de colitis refractaria a corticosteroides, considere la posibilidad de repetir los estudios de infectología para excluir etiologías alternativas. Se presentó colitis inmunomediada en el 1.7% (48/2,799) de los pacientes que recibieron KEYTRUDA, incluidas reacciones de Grado 4 (<0.1%), Grado 3 (1.1%) y Grado 2 (0.4%). Se requirieron corticosteroides sistémicos en el 69% (33/48); se requirió tratamiento inmunosupresor adicional en el 4.2% de los pacientes. La colitis provocó la interrupción permanente de KEYTRUDA en el 0.5% (15) y la suspensión en el 0.5% (13) de los pacientes. Todos los pacientes a los que se les suspendió, reiniciaron KEYTRUDA después de la mejoría de los síntomas; de éstos, el 23% tuvo recurrencia. La colitis se resolvió en el 85% de los 48 pacientes.
KEYNOTE-826: PERFIL DE TOLERABILIDAD DE KEYTRUDA + QUIMIOTERAPIA ± BEVACIZUMAB
Reacciones adversas de grado 3-5 que ocurrieron con una incidencia más alta (≥2% de diferencia) en pacientes que recibieron KEYTRUDA + quimioterapia ± bevacizumab vs. pacientes que recibieron placebo + quimioterapia ± bevacizumab en el KEYNOTE-826.1

a Quimioterapia (paclitaxel y cisplatino o paclitaxel y carboplatino).
Reacciones adversas inmunomediadas.1

*En estudios clínicos individuales de pacientes con HNSCC tratados con KEYTRUDA® como monoterapia (n=909), la incidencia de hipotiroidismo fue del 16.1% (todos los grados) con 0.3% en Grado 3.
En pacientes con HNSCC tratados con KEYTRUDA® en combinación con quimioterapia con platino y 5-FU (n=276) la incidencia de hipotiroidismo fue del 15.2%, todos de los cuales fueron de Grado 1 o 2. En pacientes con cHL (n=389) la incidencia de hipotiroidismo fue del 17%, todos de los cuales fueron grado 1 o 2. En el estudio adyuvante de pacientes con RCC resecado tratados con KEYTRUDA® como monoterapia (n=488), la incidencia de hipotiroidismo fue del 21% (todos los grados) con 0.2% de grado 3.
† En el estudio adyuvante de pacientes con RCC resecado tratados con KEYTRUDA® como monoterapia (n=488), la incidencia de hipertiroidismo fue del 12% (todos los grados) con un 0.2% de grado 3.
‡ En estudios clínicos individuales de pacientes con NSCLC tratados con KEYTRUDA® como monoterapia (total n=2,602), la incidencia de neumonitis (todos los grados) varió de 3.8% a 8.3%. En pacientes con cHL tratados con KEYTRUDA® como monoterapia, la incidencia de neumonitis (todos los grados) el intervalo fue de 5.2% a 10.8% para las pacientes con cHL en el KEYNOTE-087 (n=210) y KEYNOTE-204 (n=148), respectivamente.
§ En pacientes con NSCLC no escamoso tratados con KEYTRUDA® 200 mg en combinación con pemetrexed y quimioterapia con platino (n=405), la incidencia de nefritis fue del 1.7% (todos los grados) con 1.0% en grado 3 y 0.5% en grado 4.
La tolerabilidad de KEYTRUDA® se evaluó en 2,799 pacientes en estudios controlados y no controlados. La mediana de duración del tratamiento fue de 4.2 meses (intervalo de 1 día a 30.4 meses), incluidos 1,153 pacientes tratados durante más de o igual a 6 meses y 600 pacientes tratados durante más de o igual a 1 año. KEYTRUDA® se suspendió por reacciones adversas relacionadas con el tratamiento en el 5% de las pacientes. Los eventos adversos graves relacionados con el tratamiento (SAEs) informados hasta 90 días después de la última dosis ocurrieron en el 10% de las pacientes que recibieron KEYTRUDA®. De estos (SAEs) relacionados con el tratamiento, los más comunes fueron neumonitis, colitis, diarrea y pirexia.
Reacciones adversas adicionales reportadas con KEYTRUDA®1
- Se han producido reacciones adversas inmunomediadas, incluidos casos graves y mortales, en pacientes que recibieronKEYTRUDA®.
Pueden ocurrir reacciones adversas inmunomediadas después de la interrupción del tratamiento. En los estudios clínicos, lamayoría de las reacciones adversas inmunomediadas fueron reversibles y se manejaron con interrupciones de KEYTRUDA®, la administración de corticosteroides y/o cuidados de soporte. Pueden ocurrir de manera simultánea reacciones adversas inmunomediadas que afecten a más de un sistema corporal. - Para las sospechas de reacciones adversas inmunomediadas, asegúrese de una evaluación adecuada para confirmar la etiología oexcluir otras causas. Con base en la gravedad de la reacción adversa, suspenda KEYTRUDA® y considere la administración decorticosteroides.
- Se han notificado trastornos de la tiroides, que incluyen hipertiroidismo, hipotiroidismo y tiroiditis, en pacientes que recibenKEYTRUDA® y pueden ocurrir en cualquier momento durante el tratamiento; por lo tanto, monitoree a los pacientes para detectarcambios en la función tiroidea (al inicio del tratamiento, periódicamente durante el tratamiento y según se indique según laevaluación clínica) y los signos y síntomas clínicos de los trastornos tiroideos. El hipotiroidismo puede tratarse con terapia dereemplazo sin interrupción del tratamiento y sin corticosteroides. El hipertiroidismo puede tratarse sintomáticamente. Suspenda ointerrumpa KEYTRUDA® en caso de hipertiroidismo grave (grado 3) o potencialmente mortal (grado 4).
- Se han reportado reacciones cutáneas graves inmunomediadas en pacientes tratados con KEYTRUDA®. Monitoree a los pacientespara detectar posibles reacciones cutáneas graves y excluya otras causas. Con base en la gravedad de la reacción adversa,interrumpa o suspenda permanentemente KEYTRUDA® y administre corticosteroides.
- Se han reportado casos de SJS y TEN, algunos con desenlace fatal en pacientes tratados con KEYTRUDA®. Para los signos ysíntomas de SJS o TEN, interrumpa KEYTRUDA® y remita al paciente a atención especializada para evaluación y tratamiento. Si seconfirma SJS o TEN, suspenda permanentemente KEYTRUDA®.
- Se reportaron las siguientes reacciones adversas inmunomediadas adicionales clínicamente significativas en menos del 1% de lospacientes tratados con KEYTRUDA® en los estudios KEYNOTE-001, KEYNOTE-002, KEYNOTE-006 y KEYNOTE-010: uveítis, miositis,síndrome de Guillain-Barré, pancreatitis, encefalitis, sarcoidosis, síndrome miasténico / miastenia gravis (incluida la exacerbación),mielitis, vasculitis e hipoparatiroidismo. Lo siguiente se informó en otros estudios clínicos con KEYTRUDA® o en el uso posterior ala comercialización: miocarditis y colangitis esclerosante. En estudios clínicos o en el uso post-comercialización, se han reportadocasos de estas reacciones adversas inmunomediadas, algunas de las cuales fueron graves.
- Se ha reportado el rechazo de trasplante de órganos sólidos en el entorno posterior a la comercialización en pacientes tratados conKEYTRUDA®. El tratamiento con KEYTRUDA® puede aumentar el riesgo de rechazo al trasplante de órganos sólidos. Considere elbeneficio del tratamiento con KEYTRUDA® vs. el riesgo de posible rechazo de órganos en estos pacientes.Se han reportado GVHD aguda, incluida la GVHD mortal, después del tratamiento con KEYTRUDA® en pacientes con antecedentesde HSCT alogénico. Los pacientes que experimentaron GVHD después del procedimiento de trasplante pueden tener un mayorriesgo de GVHD después del tratamiento con KEYTRUDA®. Considere el beneficio del tratamiento con KEYTRUDA® vs. el riesgo deposible GVHD en pacientes con antecedentes de HSCT alogénico.Se han reportado frecuencias más altas de lo esperado de grados 3 y 4 en elevaciones de ALT y de AST en pacientes con RCCavanzado cuando KEYTRUDA® se administra con axitinib. Monitoree las enzimas hepáticas antes del inicio y periódicamentedurante el tratamiento. Considere un monitoreo más frecuente de las enzimas hepáticas en comparación a cuando losmedicamentos se usan en monoterapia. Siga las guías del manejo médico para ambos medicamentos.
- En dos estudios clínicos de distribución al azar en pacientes con mieloma múltiple, la adición de KEYTRUDA® a un análogo detalidomida más dexametasona un uso para el que no está indicado ningún anticuerpo bloqueador de PD-1 o PD-L1, resultó en unaumento de la mortalidad. El tratamiento de estos pacientes con un anticuerpo bloqueador de PD-1 o PD-L1 en combinación con unanálogo de talidomida más dexametasona no se recomienda fuera de los estudios clínicos controlados.
- Se han reportado reacciones graves a la infusión, que incluyen hipersensibilidad y anafilaxia, en 6 (0.2%) de 2,799 pacientes querecibieron KEYTRUDA® en los estudios KEYNOTE-001, KEYNOTE-002, KEYNOTE-006 y KEYNOTE-010. Para reacciones graves a la infusión, suspenda la infusión y suspenda KEYTRUDA® de forma permanente. Los pacientes con reacciones a la infusión leves omoderadas pueden continuar recibiendo KEYTRUDA® con una estrecha monitorización; Se puede considerar la premedicación con antipiréticos y antihistamínicos.
Manejo de las reacciones adversas inmunomediadas1
Si sospecha que su paciente está experimentando una reacción adversa inmunomediada al tratamiento con KEYTRUDA®, evalúe para confirmar la etiología o excluir otras causas. Según la gravedad de la reacción adversa, suspenda o interrumpa KEYTRUDA® y administre corticosteroides como se recomienda a continuación:
Monitoreo de pacientes
- Monitoree los signos y síntomas de neumonitis.
- Evalúe la sospecha de neumonitis con imágenes radiográficas.
Manejo de pacientes
- Administre corticosteroides para neumonitis de grado 2 o mayor.
- Suspenda KEYTRUDA® para Grado 2; descontinúe permanentemente KEYTRUDA® para neumonitis de grado 3 o 4 o recurrente de grado 2.
Monitoreo de pacientes
- Monitoree los signos y síntomas de colitis.
Manejo de pacientes
- Administre corticosteroides para colitis de grado 2 o mayor.
- Suspenda KEYTRUDA® para Grado 2 o 3; interrumpa permanentemente KEYTRUDA® para colitis de grado 4.
Monitoreo de pacientes
- Monitoree a los pacientes para detectar cambios en la función hepática y síntomas de hepatitis.
Manejo de pacientes
- Administre corticosteroides para hepatitis de grado 2 o superior y, según la gravedad de las elevaciones de las enzimashepáticas, suspenda o interrumpa KEYTRUDA®. Consulte la sección de modificaciones de dosis de la Información paraprescribir para obtener orientación específica para pacientes con carcinoma hepatocelular.
Monitoreo de pacientes
- Monitoree a los pacientes en busca de signos y síntomas de insuficiencia suprarrenal e hipofisitis (incluyendo hipopituitarismoy cambios en la función tiroidea al inicio y periódicamente durante el tratamiento) e hiperglucemia.
Manejo de pacientes
- Administre corticosteroides para tratar la insuficiencia suprarrenal y el reemplazo hormonal según esté clínicamente indicado.Suspenda KEYTRUDA® para Grado 2 y suspenda o interrumpa para insuficiencia suprarrenal o hipofisitis de Grado 3 o 4.
- Administre el reemplazo hormonal para el hipotiroidismo y se puede manejar sintomáticamente para el hipertiroidismo.Suspenda o interrumpa KEYTRUDA® para hipertiroidismo de grado 3 o 4.
- Administre insulina para la diabetes tipo 1 y suspenda KEYTRUDA® en pacientes con hiperglucemia grave.
Monitoreo de pacientes
- Monitoree a los pacientes para detectar cambios en la función renal.
Manejo de pacientes
- Administre corticosteroides para nefritis de grado 2 o mayor.
- Suspenda KEYTRUDA® para la nefritis de Grado 2 y descontinúe permanentemente KEYTRUDA® para la nefritis de Grado 3 o 4.
Monitoreo de pacientes
- Monitoree a los pacientes para detectar posibles reacciones cutáneas graves y excluya otras causas.
Manejo de pacientes
- Según la gravedad de la reacción adversa, suspenda o interrumpa permanentemente KEYTRUDA® y administre corticosteroides.
- Para signos o síntomas de SJS o TEN, suspenda KEYTRUDA® y remita al paciente a atención especializada para evaluación y tratamiento. Si se confirma SJS o TEN, interrumpa permanentemente KEYTRUDA®.
Monitoreo de pacientes
- Para las sospechas de reacciones adversas inmunomediadas, asegúrese de una evaluación adecuada para confirmar la etiología o excluir otras causas.
Manejo de pacientes
- Según la gravedad de la reacción adversa, suspenda KEYTRUDA® y administre corticosteroides.
- Después de mejorar a Grado 1 o menos, inicie la disminución gradual de los corticosteroides y continúe disminuyendo duranteal menos 1 mes. Con base en datos limitados de estudios clínicos en pacientes cuyas reacciones adversas inmuno-relacionadasno se pudieron controlar con el uso de corticosteroides, se puede considerar la administración de otros inmunosupresoressistémicos. Reinicie KEYTRUDA® si la reacción adversa permanece en el Grado 1 o menos después de la reducción de los corticosteroides. Si ocurre otro episodio de una reacción adversa grave, interrumpa permanentemente KEYTRUDA®.
Monitoreo de pacientes
- Para reacciones de grado 3 o 4, suspenda la infusión e interrumpa permanentemente KEYTRUDA®.
HSCT alogénico después del tratamiento con KEYTRUDA®
- Considere el beneficio de KEYTRUDA® frente al riesgo de GVHD en pacientes con antecedentes de HSCT alogénico.
Información para Prescribir completa – KEYTRUDA®
Información Seleccionada de Seguridad completa – KEYTRUDA®
Pembrolizumab: flexibilidad de la dosificación
C3S o C6S en pacientes adultos.1

Para uso en combinación, consulte la información de prescripción de las terapias concomitantes.
Cuando se administre KEYTRUDA como parte de una combinación con quimioterapia intravenosa, KEYTRUDA debe administrarse primero.
Información para Prescribir completa – KEYTRUDA®
Información Seleccionada de Seguridad completa – KEYTRUDA®
INFORMACIÓN SELECCIONADA DE SEGURIDAD DE KEYTRUDA
ADVERTENCIAS Y PRECAUCIONES
Reacciones adversas inmunomediadas graves y mortales
Hepatotoxicidad y hepatitis inmunomediada
KEYTRUDA como monoterapia.
KEYTRUDA puede causar hepatitis inmunomediada. Se presentó hepatitis inmunomediada en el 0.7% (19/2,799) de los pacientes que recibieron KEYTRUDA, incluidas reacciones de Grado 4 (<0.1%), Grado 3 (0.4%) y Grado 2 (0.1%). Se requirieron corticosteroides sistémicos en el 68% (13/19) de los pacientes; se requirió terapia inmunosupresora adicional en el 11% de los pacientes. La hepatitis provocó la interrupción permanente de KEYTRUDA en el 0.2% (6) y la suspensión en el 0.3% (9) de los pacientes. Todos los pacientes a los que se les suspendió, reiniciaron KEYTRUDA después de la mejoría de los síntomas y ninguno tuvo recurrencia. La hepatitis se resolvió en el 79% de los 19 pacientes.
SE DEMOSTRÓ UNA OS y PFS SUPERIOR,Y UNA MAYOR ORR CON KEYTRUDA + QUIMIOTERAPIA ± BEVACIZUMAB EN COMPARACIÓN CON PLACEBO + QUIMIOTERAPIA ± BEVACIZUMAB EN PACIENTES CUYOS TUMORES EXPRESAN PD-L1 (CPS ≥ 1)¹
- En el KEYNOTE-826, se observó una reducción del 40 % en el riesgo de muerte con KEYTRUDA + quimioterapiaª ± bevacizumab vs. placebo + quimioterapiaª ± bevacizumab (HRb = 0.60; IC del 95%, 0.49–0.74; Pc=<0.0001) en la población con CPS ≥11,2
- La mediana de OS en el brazo de Keytruda + Quimioterapia ± Bevacizumab en la población CPS≥1 fue de 28.6 meses (22.1-38.0) VS una mediana de OS de 16.5 meses (14.5-20.0) en el brazo de Placebo+Quimioterapia +Bevacizumab
a Paclitaxel y cisplatino o paclitaxel y carboplatino.1
bBasado en el modelo de riesgo proporcional estratificado de Cox.1
cEl valor P (unilateral) se compara con el alfa asignado de 0.0055 para este análisis interino (con el 72% del número planificado de eventos para el análisis final).1
Supervivencia Libre de Progresión (PFS) Superior:1
- Se observó una reducción del 42 % en el riesgo de progresión de la enfermedad o muerte con KEYTRUDA + quimioterapiaª ± bevacizumab vs. placebo + quimioterapiaª ± bevacizumab (HRb =0.58; IC del 95%, 0.47–0.71; Pc <0.0001) en la población con CPS≥11,2
- La mediana de PFS fue de 10.5 meses (IC del 95%, 9.7–12.3) con KEYTRUDA + quimioterapiaª ± bevacizumab vs. 8.2 meses (IC del 95%, 6.3–8.5) con placebo + quimioterapiaª ± bevacizumab en la población con CPS≥1
a Paclitaxel y cisplatino o paclitaxel y carboplatino.1
b Basado en el modelo de riesgo proporcional estratificado de Cox.1
c El valor P (unilateral) se compara con el alfa asignado de 0.0014 para este análisis interino (con el 82% del númeron planificado de eventos para el análisis final)1
Mayor Tasa de Respuesta Objetiva (ORR):
- El 68,5% de las pacientes lograron una respuesta objetivaa (IC del 95%, 62–74) a KEYTRUDA + quimioterapiab ± bevacizumab vs. 50,9% de las pacientes (IC del 95%, 44,8–57) para placebo + quimioterapiab ± bevacizumab en la población con CPS ≥11
- El 25,6% de las pacientes experimentaron una respuesta completa con KEYTRUDA + quimioterapiab ± bevacizumab vs. 14,5% con placebo + quimioterapiab ± bevacizumab en la población con CPS ≥11
- El 42,9% de las pacientes experimentaron una respuesta parcial con KEYTRUDA + quimioterapiab ± bevacizumab vs. 36,4% con placebo + quimioterapiab ± bevacizumab en la población con CPS ≥11
a Respuesta: Mejor respuesta objetiva como respuesta completa confirmada o respuesta parcial.1
bPaclitaxel y cisplatino o paclitaxel y carboplatino.1
Información para Prescribir completa – KEYTRUDA®
Información Seleccionada de Seguridad completa – KEYTRUDA®
INFORMACIÓN SELECCIONADA DE SEGURIDAD DE KEYTRUDA
ADVERTENCIAS Y PRECAUCIONES
Reacciones adversas inmunomediadas graves y mortales
Endocrinopatías inmunomediadas
Insuficiencia suprarrenal.
KEYTRUDA puede causar insuficiencia suprarrenal primaria o secundaria. Para Grado 2 o mayor, inicie tratamiento sintomático, incluya reemplazo hormonal como esté indicado clínicamente. Suspenda KEYTRUDA dependiendo de la gravedad. Se presentó insuficiencia suprarrenal en el 0.8% (22/2,799) de los pacientes que recibieron KEYTRUDA, incluidas reacciones de Grado 4 (<0.1%), Grado 3 (0.3%) y Grado 2 (0.3%). Se requirieron corticosteroides sistémicos en el 77% (17/22) de los pacientes y la mayoría de éstos permaneció con corticosteroides sistémicos. La insuficiencia suprarrenal provocó la suspensión permanente de KEYTRUDA en el < 0.1% (1) y la suspensión en el 0.3% (8) de los pacientes. Todos los pacientes a los que se les suspendió, reiniciaron KEYTRUDA después de la mejoría de los síntomas.
Abreviaturas
ALT = alanina aminotransferasa;
AST = aspartato aminotransferasa;
AUC = área bajo la curva;
C3S = cada 3 semanas;
C6S = cada 6 semanas;
cHL = Linfoma de Hodgkin clásico;
CPS = escala combinada positiva;
DOR = duración de la respuesta;
ECOG PS = Estado Funcional según el Grupo Oncológico Cooperativo del Este;
GVHD =enfermedad injerto contra huésped;
HR = razón de riesgos;
HNSCC = carcinoma de células escamosas de cabeza y cuello;
HSCT = trasplante de células progenitoras Hematopoyéticas;
IC = intervalo de confianza;
IHC = inmunohistoquímica;
NCCN = Red Oncológica Integral del Cáncer (NCCN ) de EUA;
NR = no alcanzado;
NSCLC = cáncer de pulmón de células no pequeñas;
ORR = tasa de respuesta objetiva;
OS = supervivencia global;
PD-1 = receptor de muerte programada 1;
PD-L1 = ligando 1 de muerte programada;
PFS = supervivencia libre de progresión;
RCC = carcinoma de células renales;
RECIST 1. 1 = Criterios de Evaluación de Respuesta en Tumores Sólidos v1.1;
SJS = síndrome de Stevens-Johnson;
TEN = necrólisis epidérmica tóxica
Referencias
- Información para prescribir de KEYTRUDA.
- Colombo N, Dubot C, Lorusso D, y cols. Pembrolizumab for persistent, recurrent, or metastaticcervical cancer. N Engl J Med. 2021;385(20):1856–1867. doi:10.1056/NEJMoa2112435.
- Agilent Technologies, Inc. Instrucciones de uso: PD-L1 IHC 22C3 pharmDx.
- Referenciado con autorización de la Guía de práctica clínica en oncología de la NCCN (NCCNGuidelines®) para el cáncer cervicouterino. V.1.2023. © National Comprehensive Cancer Network,Inc. 2022. Todos los derechos reservados. Consultado el 27 de febrero de 2023. Para ver laversión de la guía más reciente y completa, visite NCCN.org.