TRATAMIENTO DE LA NEUMONÍA NOSOCOMIALEN LA UCI
NUEVAS RECOMENDACIONES DE UN GRUPO DE EXPERTOS*

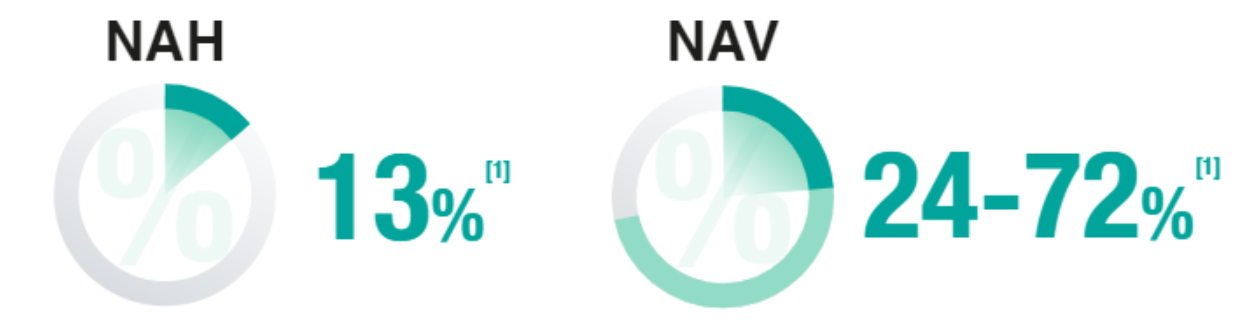
10-40
de los pacientes sometidos a ventilación mecánica >48 horas desarrollan NAV[1].
Tasa de mortalidad de la neumonía nosocomial
• La selección de un tratamiento antibiótico inadecuado es el principal factor de mal pronóstico en la neumonía nosocomial[1].
• Debe iniciarse tratamiento antibiótico empírico adecuado lo más pronto posible en el paciente con neumonía nosocomial[1]
Tratamiento empírico de la neumonía nosocomial en la UCI

†Asociar linezolid o vancomicina de acuerdo con la incidencia local de S. aureus resistente a meticilina.
Tratamiento específico de la neumonía nosocomial en la UCI
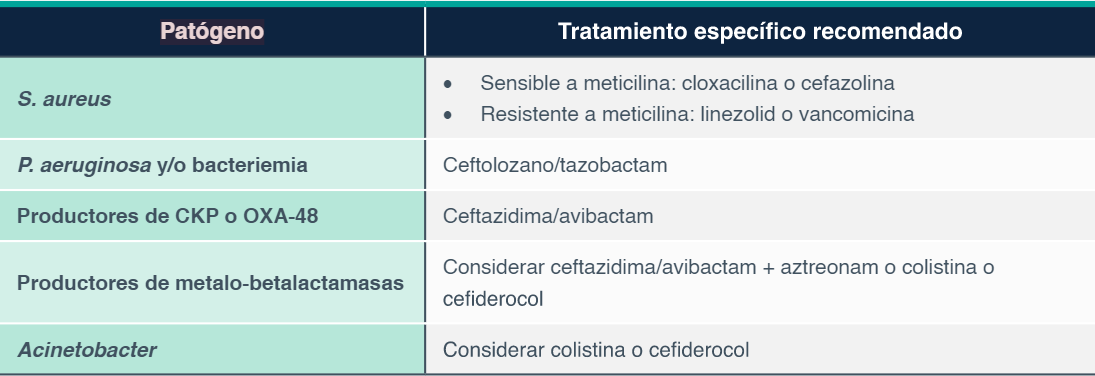
CKP = carbapenemasas similares a la de K. pneumoniae
Adaptado de [1]
Nuevas opciones terapéuticas
• Se recomienda ceftolozano/tazobactam para las infecciones por P. aeruginosa[1].

Ceftolozano/tazobactam tiene la mayor actividad in vitro contra P. aeruginosa vs. los demás agentes anti-Pseudomonas[1].

En pacientes con NAH que requirieron ventilación mecánica invasiva, ceftolozano/tazo-bactam se asoció con menor mortalidad vs. meropenem (24,2% vs. 37%)[1]
• Se recomienda ceftazidima/avibactam para las infecciones por enterobacterias producto-ras de carbapenemasas similares a las de K. pneumoniae[1].
*Consenso de un grupo interdisciplinario de expertos europeos basado en una revisión de la literatura reciente[1].
CKP = carbapenemasas similares a la de K. pneumoniae; NAHV = neumonía adquirida en el hospital que requiere ventilación; NAH = neumonía adquirida en el hospital; NAV = neumonía asociada al ventilador; PCR = reacción en cadena de la polimerasa;TA = tratamiento antibiótico. Adaptado de [1]
1. Zaragoza R, Vidal-Cortés P, Aguilar G, et al. Update of the treatment of nosocomial pneumonia in the ICU. Crit Care. 2020;24(1):383.
La información de prescripción de este medicamento la cual incluye: indicaciones, contraindicaciones, precauciones, advertencias, reacciones adversas, etc., se encuentra disponible para el cuerpo médico en el siguiente código QR.

Antes de prescribir Zerbaxa® por favor consulte la Circular de Producto completa y vigente en su país. MSD no recomienda el uso de producto alguno, en una forma diferente de la que está descrita en la Circular de Producto vigente.
Información Seleccionada de Seguridad sobre ZERBAXA®
Contraindicaciones
• Hipersensibilidad a los principios activos o a alguno de los excipientes
• Hipersensibilidad a cualquier medicamento antibacteriano con cefalosporina
• Hipersensibilidad grave (por ejemplo, reacción anafiláctica, reacción cutánea grave) a cualquier otro tipo de agente antibacteriano beta-lactámico (por ejemplo, penicilinas o carbapenémicos).
Advertencias / Precauciones generales
• Reacciones de hipersensibilidad
• Ceftolozano/tazobactamestá contraindicado en pacientes con antecedentes de hipersensibilidad a ceftolozano, tazobactam, o cefalosporinas.
• Ceftolozano/tazobactam está contraindicado en pacientes con hipersensibilidad grave (por ejemplo, reacción anafiláctica, reacción cutánea grave) a cualquier otro tipo de agente antibacteriano beta-lactámico (por ejemplo, penicilinas o carbapenémicos).
• Ceftolozano/tazobactam se debe utilizar con precaución en pacientes con antecedentes de cualquier otro tipo de reacción de hipersensibilidad a las penicilinas u otros agentes antibacterianos beta-lactámicos.
• Efecto en la función renal.
• Se ha visto una disminución en la función renal en pacientes que recibieron ceftolozano/tazobactam. Insuficiencia renal.
• Según la función renal se debe ajustar la dosis de ceftolozano/tazobactam.
En los ensayos clínicos de infecciones intraabdominales complicadas e infecciones del tracto urinario complicadas, incluida pielonefritis, la eficacia de ceftolozano/tazobactam fue más baja en pacientes con insuficiencia renal moderada comparada con aquellos que presentan al inicio función renal normal o insuficiencia renal leve. Los pacientes con insuficiencia renal al inicio se deben monitorizar frecuentemente ante cualquier cambio en la función renal durante el tratamiento y si es necesario se debe ajustar la dosis de ceftolozano/tazobactam.
• Limitaciones de los datos clínicos
• Los pacientes inmunodeprimidos, los pacientes con neutropenia grave y los pacientes con enfermedad renal terminal en hemodiálisis fueron excluidos de los ensayos clínicos.
Infecciones intraabdominales complicadas
En un ensayo en pacientes con infecciones intraabdominales complicadas, el diagnóstico más común fue perforación apendicular o absceso peri-apendicular (420/970 [43,3 %] de los pacientes), de los cuales 137/420 (32,6 %) tuvieron peritonitis difusa al inicio. Aproximadamente el 82 % de todos los pacientes en el ensayo tuvieron una puntuación de APACHE II (evaluación de salud crónica y fisiología aguda II) < 10 y el 2,3 % tuvieron bacteriemia al inicio. En los pacientes clínicamente evaluables, las tasas de curación clínica para ceftolozano/tazobactam fueron del 95,9 % en 293 pacientes con edad inferior a 65 años y del 87,8 % en 82 pacientes de 65 años de edad o mayores.
Infecciones del tracto urinario complicadas
Los datos de eficacia clínica en pacientes con infección del tracto urinario inferior complicada son limitados. En un ensayo clínico aleatorizado con control activo el 18,2 % (126/693) de los pacientes microbiológicamente evaluables tuvieron infecciones del tracto urinario inferior complicadas, incluyendo 60/126 pacientes que fueron tratados con ceftolozano/tazobactam. Uno de estos 60 pacientes presentaba bacteriemia al inicio.
• Diarrea asociada a Clostridioides difficile
Se han notificado casos de colitis y de colitis pseudomembranosa asociadas a antibacterianos con ceftolozano/tazobactam (ver sección 4.8). La gravedad de estos tipos de infección puede variar entre leve y potencialmente mortal. Por lo tanto, es importante considerar este diagnóstico en pacientes que presenten diarrea durante o después de la administración de ceftolozano/tazobactam. En estos casos, se debe considerar la interrupción del tratamiento con ceftolozano/tazobactam y la adopción de medidas de apoyo junto con la administración del tratamiento específico para Clostridioides difficile.
• Microorganismos no sensibles
El uso de ceftolozano/tazobactam puede estimular el crecimiento excesivo de microorganismos no sensibles. Si durante o después del tratamiento aparece una infección desmesurada, se debe tomar las medidas apropiadas. Ceftolozano/tazobactam no es activo frente a bacterias que producen enzimas beta-lactamasa que no son inhibidas por tazobactam.
• Seroconversión mediante la prueba de antiglobulina directa (prueba de Coombs) y riesgo potencial de anemia hemolítica
Durante el tratamiento con ceftolozano/tazobactam, la prueba de antiglobulina directa (PDC) puede dar positivo. En los estudios clínicos no hubo evidencia de hemólisis en los pacientes que desarrollaron PDC positivo durante el tratamiento.
• Contenido en sodio
Ceftolozano/tazobactam contiene 230 mg de sodio por vial, equivalente a 11,5 % de la ingesta máxima diaria de 2 g de sodio recomendada por la OMS para un adulto. El vial reconstituido con 10 ml de cloruro de sodio al 0,9 % (solución salina fisiológica) para preparaciones inyectables contiene 265 mg de sodio por vial, equivalente a 13,3 % de la ingesta máxima diaria de 2 g de sodio recomendada por la OMS para un adulto.
• Embarazo
No hay datos relativos al uso de ceftolozano/tazobactam en mujeres embarazadas. Tazobactam atraviesa la placenta. Se desconoce si ceftolozano atraviesa la placenta.
• Lactancia
Se desconoce si ceftolozano/tazobactam se excreta en la leche materna.
• Fertilidad
No se han estudiado los efectos de ceftolozano y tazobactam sobre la fertilidad en humanos.
• Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Zerbaxa sobre la capacidad para conducir y utilizar máquinas puede ser pequeña. Puede aparecer mareos después de la administración de Zerbaxa. • PediatríaNo se ha establecido la seguridad y eficacia en los pacientes pediátricos.
• Pacientes de edad avanzada
No se recomienda ajustar la dosis de ceftolozano/tazobactam en función de la edad únicamente. Ni en función del sexo, ni raza.
• Precauciones
Conservar en refrigeración (entre 2 ºC y 8 ºC) conservar en el empaque original para proteger de la luz. Cada vial es de un solo uso únicamente.
ADVERTENCIA: LA SOLUCIÓN RECONSTITUIDA NO SE DEBE INYECTAR DIRECTAMENTE
Reacciones secundarias o adversas:
• Resumen del perfil de seguridad
• Se evaluó Zerbaxa en ensayos clínicos de fase 3 controlados con comparador activo en infecciones intraabdominales complicadas y en infecciones del tracto urinario complicadas (incluida la pielonefritis), en los que participaron 1.015 pacientes en total que fueron tratados con Zerbaxa (1 g/0,5 g por vía intravenosa cada 8 horas, dosis ajustada según la función renal si procedía) durante un máximo de 14 días. Las reacciones adversas más frecuentes (≥ 3 % en los ensayos clínicos de fase 3 agrupados de infecciones intraabdominales complicadas e infecciones del tracto urinario complicadas, incluida pielonefritis) que ocurrieron en los pacientes tratados con Zerbaxa fueron náuseas, cefalea, estreñimiento, diarrea y pirexia, por lo general, fueron de intensidad leve o moderada.
• Se evaluó Zerbaxa en un ensayo clínico de fase 3 controlado con comparador activo en neumonía adquirida en el hospital, incluida neumonía asociada a la ventilación mecánica, en el que participaron 361 pacientes en total tratados con Zerbaxa (2 g/1 g por vía intravenosa cada 8 horas, dosis ajustada según la función renal si procedía) durante un máximo de 14 días.
• Las reacciones adversas más frecuentes (≥ 5 % en el ensayo clínico de fase 3 de neumonía adquirida en el hospital, incluida neumonía asociada a la ventilación mecánica) que ocurrieron en los pacientes tratados con Zerbaxa fueron diarrea, alanina aminotransferasa elevada y aspartato aminotransferasa elevada, que por lo general fueron de intensidad leve o moderada.
• Se han identificado las siguientes reacciones adversas durante los ensayos clínicos con Zerbaxa. Las reacciones adversas están clasificadas conforme a la clasificación de órganos y frecuencias del sistema MedDRA. Las categorías de frecuencia proceden de la siguiente convención: frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1.000 a < 1/100).
• Descripción de reacciones adversas seleccionadas
• Pruebas de laboratorio
Durante el tratamiento con Zerbaxa, la prueba de Coombs directa puede dar positivo. La incidencia de seroconversión a la prueba de Coombs directa positiva fue del 0,2 % en pacientes que recibieron Zerbaxa y del 0% en pacientes que recibieron el comparador en los ensayos clínicos de infecciones intraabdominales complicadas e infecciones del tracto urinario complicadas. La incidencia de seroconversión a la prueba de Coombs directa positiva fue del 31,2 % en pacientes que recibieron Zerbaxa y del 3,6 % en pacientes que recibieron meropenem en un estudio clínico de neumonía adquirida en el hospital, incluida neumonía asociada a la ventilación mecánica. En los estudios clínicos no hubo, en ningún grupo de tratamiento, evidencia de hemólisis en los pacientes que desarrollaron prueba de Coombs directa positiva.
• Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación.
• Sobredosis
No hay experiencia de sobredosis con Zerbaxa. La dosis individual más alta de Zerbaxa utilizada en ensayos clínicos fue de 3 g/1.5 g de Ceftolozano/tazobactam administrada a voluntarios sanos. En caso de sobredosis, se debe eliminar Zerbaxa mediante hemodiálisis.
Interacción con otros medicamentos:
No se esperan interacciones medicamentosas significativas entre ceftolozano/tazobactam y los sustratos, inhibidores e inductores de las enzimas del citocromo P450 (CYP) según los estudios in vitro e in vivo.
Los estudios in vitro demostraron que ceftolozano, tazobactam y el metabolito M1 de tazobactam no inhibieron CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ni CYP3A4 y tampoco indujeron CYP1A2, CYP2B6 o CYP3A4 a las concentraciones plasmáticas terapéuticas.
Ceftolozano y tazobactam no fueron sustratos de P-gp o BCRP y tazobactam no fue un sustrato de OCT2 in vitro a las concentraciones plasmáticas terapéuticas. Los datos in vitro indican que ceftolozano no inhibió in vitro P-gp, BCRP, OATP1B1, OATP1B3, OCT1, OCT2, MRP, BSEP, OAT1, OAT3, MATE1 ni MATE2-K a las concentraciones plasmáticas terapéuticas. Los datos in vitro indican que ni tazobactam ni el metabolito M1 de tazobactam inhiben los transportadores de P-gp, BCRP, OATP1B1, OATP1B3, OCT1, OCT2 o BSEP a las concentraciones plasmáticas terapéuticas.
Tazobactam es un sustrato de OAT1 y OAT3. In vitro, tazobactam inhibió los transportadores OAT1 y OAT3 humanos con valores de CI50 de 118 y 147 microgramos/ml, respectivamente. La administración conjunta de ceftolozano/tazobactam con el sustrato de OAT1 y OAT3 furosemida en un estudio clínico no aumentó significativamente las exposiciones plasmáticas de furosemida (relación media geométrica de 0,83 y 0,87 para Cmáx y AUC, respectivamente). Sin embargo, los principios activos que inhiben OAT1 u OAT3 (p. ej., probenecid) pueden aumentar las concentraciones plasmáticas de tazobactam.