Inmunogenicidad posterior a la segunda dosis durante el primer año de vida
VAXNEUVANCE® demostró inmunogenicidad comparable después de la segunda dosis durante el primer año de vida, cuando los niños presentan el mayor riesgo de ENI2,3
Respuestas inmunitarias comparables en todos los serotipos
compartidos con PCV13 y respuestas inmunitarias superiores en 22F y 33F3,4
VAXNEUVANCE® vs. PCV133
Objetivo final secundario: tasa de respondedores a los 30 días de la segunda dosis de la serie primaria3
(Respondedores = IgG ≥ 0,35 µg/mL)
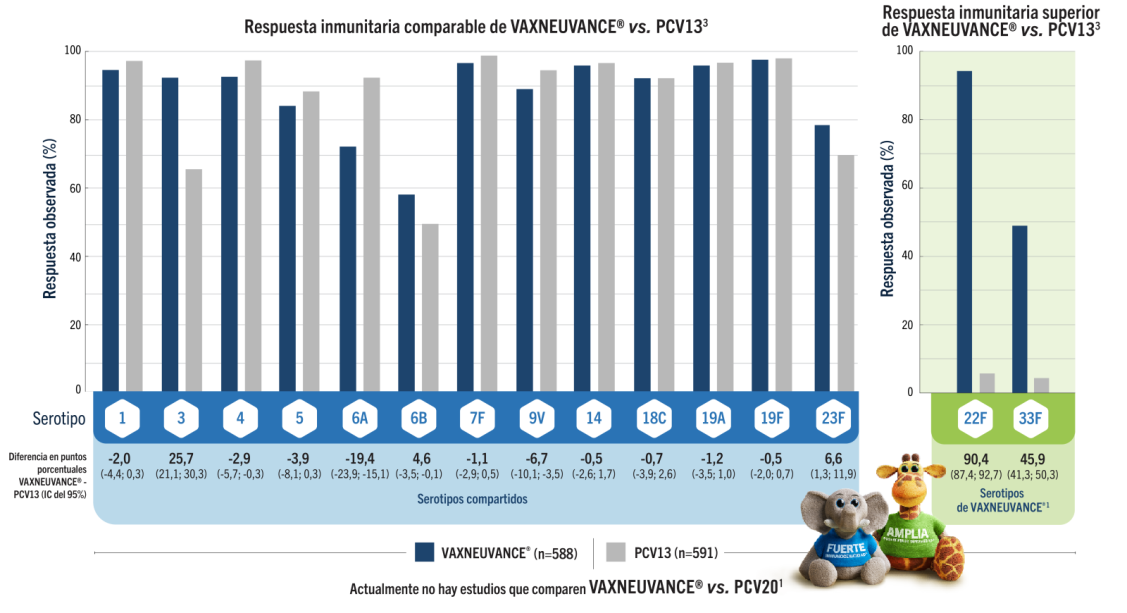
*Los datos adicionales sobre respuestas inmunitarias durante el primer año de vida se obtuvieron a partir de pruebas secundarias evaluadas con estadística descriptiva.3
IC: intervalo de confianza; IgG: inmunoglobulina G; ENI: enfermedad neumocócica invasiva; PCV13: vacuna neumocócica conjugada de 13 serotipos.
Referencias:
1. Información para prescribir de VAXNEUVANCE®. 2. European Centre for Disease Prevention and Control. Surveillance Atlas of Infectious Diseases. Disponible en: http://atlas.ecdc.europa.eu/public/index.aspx. Consultado el 14 dejulio de 2024. 3. Martinon-Torres F, Wysocki J, Szenborn L, y cols. A phase III, multicenter, randomized, double-blind, active comparator-controlled study to evaluate the safety, tolerability, and immunogenicity of V114 compared with PCV13 in healthy infants (PNEU-PED-EU-l). Vaccine. 2023;41(21):3387-3398. 4. Martinon-Torres F, Wysocki J, Szenborn L, y cols. A phase III, multicenter, randomized, double-blind, active comparator-controlled study to evaluate the safety, tolerability, and immunogenicity of V114 compared with PCV13 in healthy infants (PNEU-PED-EU-1). Appendix A. Supplementary data. Vaccine, 41(15), 2456–2465. https://doi.org/10.1016/j.vaccine.2023.02.041.
REACCIONES ADVERSAS
Población pediátrica
Lactantes y niños de 6 semanas a 2 años de edad
La seguridad de VAXNEUVANCE® en lactantes sanos, incluidos los prematuros (a partir de 6 semanas de edad en el momento de la primera vacunación) y niños (de 11 a 15 meses de edad) se evaluó como pauta de vacunación de 3 dosis o de 4 dosis en 5 estudios clínicos con un total de 7.229 participantes.
Los 5 ensayos evaluaron la seguridad de VAXNEUVANCE® cuando se administró de forma concomitante con otras vacunas pediátricas de rutina. En estos estudios, 4.286 participantes recibieron una pauta completa de VAXNEUVANCE®, 2.405 participantes recibieron una pauta completa de la vacuna antineumocócica polisacárida conjugada (VNC) 13-valente y 538 participantes recibieron VAXNEUVANCE® para completar una pauta iniciada con la VNC 13-valente (pauta mixta).
Las reacciones adversas más frecuentes fueron pirexia ≥38 °C (75,2%), irritabilidad (74,5%), somnolencia (55,0%), dolor en el lugar de la inyección (44,4%), eritema en el lugar de la inyección (41,7%), pérdida de apetito (38,2%), induración en el lugar de la inyección (28,3%) e inflamación en el lugar de la inyección (28,2%) según los resultados en 3.589 participantes (Tabla 1), excluyendo a los participantes que recibieron una pauta mixta. La mayoría de las reacciones adversas notificadas fueron de leves a moderadas (según su intensidad o tamaño) y de corta duración (≤3 días). Se produjeron reacciones graves (definidas como estar sumamente molesto o ser incapaz de realizar las actividades habituales o tener un tamaño de la reacción en el lugar de la inyección >7,6 cm) en ≤3,5% de los lactantes y niños después de cualquier dosis, con la excepción de la irritabilidad que se produjo en el 11,4% de los participantes.
Niños y adolescentes de 2 a 18 años de edad
Se evaluó la seguridad de VAXNEUVANCE® en niños y adolescentes sanos en un estudio que incluyó a 352 participantes de 2 años a 18 años de edad, de los que 177 recibieron una sola dosis de VAXNEUVANCE®. En este grupo de edad, el 42,9% de todos los participantes tenía antecedentes de vacunación previa con una vacuna antineumocócica conjugada de menor valencia.
Las reacciones adversas más frecuentes fueron dolor en el lugar de la inyección (54,8%), mialgia (23,7%), inflamación en el lugar de la inyección (20,9%), eritema en el lugar de la inyección (19,2%), fatiga (15,8%), cefalea (11,9%), induración en el lugar de la inyección (6,8%) y pirexia ≥38 °C (5,6%) (Tabla 1). La mayoría de las reacciones adversas notificadas fueron de leves a moderadas (según la intensidad o tamaño) y de molesto o no ser capaz de hacer las actividades habituales o un tamaño de la reacción en el lugar de la inyección >7,6 cm) en ≤4,5% de los niños y adolescentes.
Adultos mayores de 18 años de edad
La seguridad de VAXNEUVANCE® en adultos sanos e inmunocompetentes fue evaluada en 6 estudios clínicos en 7.136 adultos ≥ 18 años de edad. Un ensayo clínico adicional evaluó a 302 adultos ≥ 18 años de edad con VIH. VAXNEUVANCE® se administró a 5.630 adultos; 1.241 tenían entre 18 y 49 años de edad, 1.911 tenían entre 50 y 64 años de edad, y 2.478 tenían 65 años de edad o más. De los que recibieron VAXNEUVANCE®, 1.134 fueron adultos inmunocompetentes de 18 a 49 años de edad que no tenían (n=285), 1 (n=620) o ≥ 2 (n=229) factores de riesgo de enfermedad neumocócica y 152 fueron adultos ≥ 18 años de edad con VIH.
Además, 5.253 adultos no habían recibido previamente una vacuna antineumocócica y 377 adultos habían sido previamente vacunados con vacuna antineumocócica polisacárida 23 – valente (VPP23) al menos 1 año antes del reclutamiento.
Las reacciones adversas más frecuentemente notificadas tras la vacunación con VAXNEUVANCE® fueron reportadas. En el análisis agrupado de los 7 estudios, las reacciones adversas más frecuentes fueron dolor en el lugar de la inyección (64,6%), fatiga (23,4%), mialgia (20,7%), cefalea (17,3%), hinchazón en el lugar de inyección (16,1%), eritema en el lugar de inyección (11,3%) y artralgia (7,9%) (Tabla 1). La mayoría de las reacciones adversas notificadas fueron leves (según la intensidad o tamaño) y de corta duración (≤ 3 días); las reacciones graves (definidas como un acontecimiento que impide la actividad diaria normal o de tamaño de la reacción en el lugar de la inyección > 10 cm) se produjeron en≤ 1,5% de los adultos a lo largo del programa clínico.
Los adultos de mayor edad notificaron menos reacciones adversas que los adultos más jóvenes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación.
INCOMPATIBILIDADES
En ausencia de estudios de compatibilidad, esta vacuna no se debe mezclar con otros medicamentos.
Antes de administrar VAXNEUVANCE®, consulte la información para prescribir completa.

