Inmunogenicidad posterior a la tercera dosis en niños pequeños
VAXNEUVANCE® obtuvo respuestas inmunitarias sólidas para TODOS los serotipos compartidos con PCV13 y respuestas inmunitarias superiores para los serotipos 22F y 33F.2,3
No se han realizado estudios controlados con distribución al azar que
evalúen la eficacia clínica de VAXNEUVANCE® comparada con PCV13.1
VAXNEUVANCE® vs. PCV13
Objetivo final primario: tasa de respondedores a los 30 días después de la dosis 3: Dosis para niños pequeños
(Respondedores = IgG ≥0,35 µg/ml)2,3
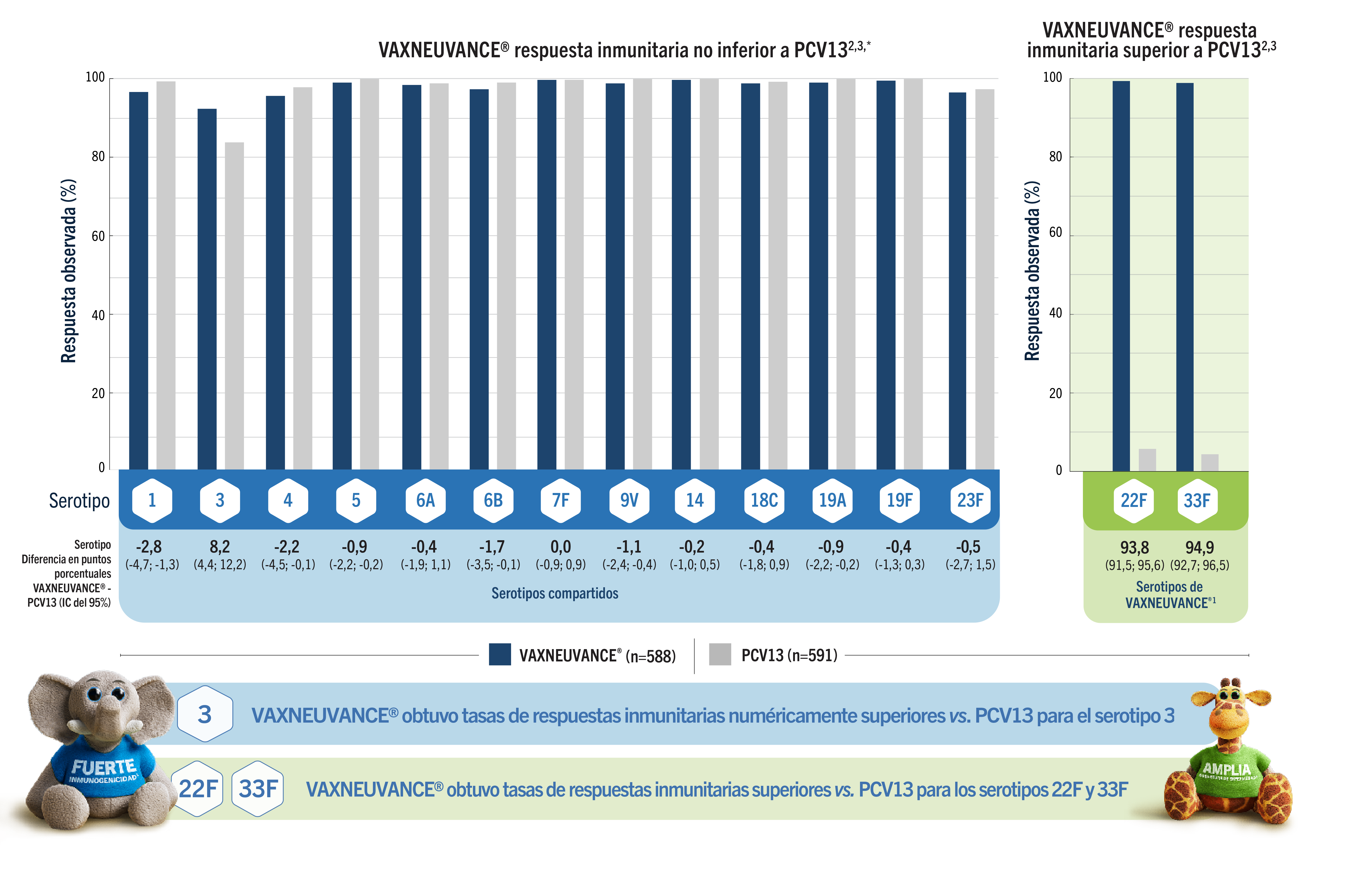
*Los respondedores fueron niños pequeños que alcanzaron el umbral de protección recomendado por la OMS, definido como IgG específica del serotipo ≥ 0,35 µg/mL.3
Actualmente no hay estudios que comparen VAXNEUVANCE® vs. PCV201
El serotipo 3 sigue siendo una de las principales causas de ENI en lactantes y niños5,a


A pesar del descenso en las tasas de ENI, el porcentaje de casos provocados por el serotipo 3 aumentó de 2014 a 2022 en Europa en lactantes y niños5,6,a

Porcentaje de casos de ENI atribuidos al serotipo 3 en lactantes menores a 1 año de edad: 5,1% (2014), 11,5% (2022); niños de 1 a 4 años de edad: 4,7% (2014), 20,3% (2022).5
VAXNEUVANCE® obtuvo tasas de respuestas inmunitarias numéricamente superiores vs. PCV13 para el serotipo 31
No se han realizado estudios controlados con distribución al azar que evalúen la eficacia clínica de VAXNEUVANCE® comparada con PCV131
Diseño del estudio (Protocolo V114-025): Estudio de fase III, aleatorizado, controlado con comparador activo, multicéntrico, de grupos paralelos, doble ciego llevado a cabo en 58 centros en 9 países, en el que se evaluó el perfil de seguridad, tolerabilidad e inmunogenicidad de V114 comparada con PCV13 en niños sanos de aproximadamente 2 meses de edad al momento del enrolamiento. El estudio incluyó 1.184 niños sanos de entre 42 y 90 días de edad al momento del enrolamiento. Los criterios de exclusión incluyeron: historia de ENI o cultivo positivo para neumococo; hipersensibilidad conocida a algún componente de la vacuna conjugada contra el neumococo (PCV), hipersensibilidad a algún componente de las vacunas administradas concomitantemente o al toxoide diftérico contenido en la vacuna; alguna contraindicación para la administración de vacunas concomitantes aplicadas durante el estudio;historia de enfermedad febril reciente; inmunodeficiencia o autoinmunidad. Los pacientes fueron aleatorizados 1:1 para recibir V114 (n = 591) o PCV13 (n = 593). Los participantes nacidos a término recibieron un esquema 3 + 1 (serie primaria de 3 dosis, más una dosis para niños pequeños) a los 2, 4 y 11 a 15 meses de edad, mientras que los participantes pretérmino (<37 semanas) recibieron un esquema 2 + 1 (serie primaria de 2 dosis, más una dosis para niños pequeños) a los 2, 3, 4 y 11 a 15 meses de edad. El estudio se llevó a cabo desde septiembre de 2019 hasta agosto de 2021. Los objetivos finales primarios fueron: De seguridad y tolerabilidad: proporción de participantes con AEs en el sitio de inyección solicitados desde el día 1 hasta el día 14 postvacunación, proporción de participantes con AEs sistémicos desde el día 1 a 14 postvacunación y proporción de pacientes con AEs durante todo el estudio; De inmunogenicidad: comparar la no inferioridad de la respuesta inmune de V114 vs PCV13 para serotipos compartidos y la superioridad de la respuesta inmune para los serotipos adicionales presentes en V114 (22F y 33F).2
IC: intervalo de confianza; IgG: inmunoglobulina G; ENI: enfermedad neumocócica invasiva; PCVI3: vacuna antineumocócica conjugada de 13 serotipos; PCV20: vacuna antineumocócica conjugada de 20 serotipos, OMS, Organización Mundial de la Salud.
aDatos provenientes de los siguientes países: Austria, Bélgica, Bulgaria, Chipre, Croacia, Dinamarca, Eslovaquia, Eslovenia, España, Estonia, Finlandia, Francia, Grecia, Hungría, Irlanda, Islandia, Italia, Letonia, Liechtenstein y República Checa, Lituaniuega, Países Bajos, Polonia, Portugal, Reino Unido, República Checa, Rumanía y Suecia; 2014 y 2022, con datos del Reino Unido hasta 2019.5
Referencias:
1. Información para prescribir de VAXNEUVANCE®. 2. Martinon-Torres F, Wysocki J, Szenborn L, y cols. A phase III, multicenter, randomized, double-blind, active comparator-controlled study to evaluate the safety, tolerability, and immunogenicity of V114 compared with PCV13 in healthy infants (PNEU-PED-EU-1). Vaccine . 2023;41(21):3387-3398. 3. Martinon-Torres F, Wysocki J, Szenborn L, y cols. A phase Ill, multicenter, randomized, double-blind, active comparator-controlled study to evaluate the safety, tolerability, and immunogenicity of compared with PCV13 in healthy infants(PNEU- PED-EU-1). Appendix A. Supplementary data. Vaccine, 41(15), 2456-2465. https://doi.org/10.1016/j.vaccine.2023.02.041. 4. Organización Mundial de la Salud. Immunological basis for immunization series: module-12: pneumococcal vaccine. Disponible en: https://www.who.int/publications/item/who-immunologicall-basis-for-immunization-series-module-12- pneumococcal-vaccine . Consultado el 5 de enero de 2024. 5. European Centre for Disease Prevention and Control. Surveillance Atlas of Infectious Diseases. Disponible en: http://atlas.eedc.europa.eu/public/index.aspx . Consultado el 14 de julio de 2024. 6. European Centre for Disease Prevention and Control. Factsheet about pneumococcal disease. Última actualización: 28 de noviembre de 2023.Disponible en: https://www.ecdc.europa.eu/en/pneumococcal-disease/facts . Consultado el 31 de julio de 2024. about 6 hours ago (v0.2) .
REACCIONES ADVERSAS
Población pediátrica
Lactantes y niños de 6 semanas a 2 años de edad
La seguridad de VAXNEUVANCE® en lactantes sanos, incluidos los prematuros (a partir de 6 semanas de edad en el momento de la primera vacunación) y niños (de 11 a 15 meses de edad) se evaluó como pauta de vacunación de 3 dosis o de 4 dosis en 5 estudios clínicos con un total de 7.229 participantes.
Los 5 ensayos evaluaron la seguridad de VAXNEUVANCE® cuando se administró de forma concomitante con otras vacunas pediátricas de rutina. En estos estudios, 4.286 participantes recibieron una pauta completa de VAXNEUVANCE®, 2.405 participantes recibieron una pauta completa de la vacuna antineumocócica polisacárida conjugada (VNC) 13-valente y 538 participantes recibieron VAXNEUVANCE® para completar una pauta iniciada con la VNC 13-valente (pauta mixta).
Las reacciones adversas más frecuentes fueron pirexia ≥38 °C (75,2%), irritabilidad (74,5%), somnolencia (55,0%), dolor en el lugar de la inyección (44,4%), eritema en el lugar de la inyección (41,7%), pérdida de apetito (38,2%), induración en el lugar de la inyección (28,3%) e inflamación en el lugar de la inyección (28,2%) según los resultados en 3.589 participantes (Tabla 1), excluyendo a los participantes que recibieron una pauta mixta. La mayoría de las reacciones adversas notificadas fueron de leves a moderadas (según su intensidad o tamaño) y de corta duración (≤3 días). Se produjeron reacciones graves (definidas como estar sumamente molesto o ser incapaz de realizar las actividades habituales o tener un tamaño de la reacción en el lugar de la inyección >7,6 cm) en ≤3,5% de los lactantes y niños después de cualquier dosis, con la excepción de la irritabilidad que se produjo en el 11,4% de los participantes.
Niños y adolescentes de 2 a 18 años de edad
Se evaluó la seguridad de VAXNEUVANCE® en niños y adolescentes sanos en un estudio que incluyó a 352 participantes de 2 años a 18 años de edad, de los que 177 recibieron una sola dosis de VAXNEUVANCE®. En este grupo de edad, el 42,9% de todos los participantes tenía antecedentes de vacunación previa con una vacuna antineumocócica conjugada de menor valencia.
Las reacciones adversas más frecuentes fueron dolor en el lugar de la inyección (54,8%), mialgia (23,7%), inflamación en el lugar de la inyección (20,9%), eritema en el lugar de la inyección (19,2%), fatiga (15,8%), cefalea (11,9%), induración en el lugar de la inyección (6,8%) y pirexia ≥38 °C (5,6%) (Tabla 1). La mayoría de las reacciones adversas notificadas fueron de leves a moderadas (según la intensidad o tamaño) y de molesto o no ser capaz de hacer las actividades habituales o un tamaño de la reacción en el lugar de la inyección >7,6 cm) en ≤4,5% de los niños y adolescentes.
Adultos mayores de 18 años de edad
La seguridad de VAXNEUVANCE® en adultos sanos e inmunocompetentes fue evaluada en 6 estudios clínicos en 7.136 adultos ≥ 18 años de edad. Un ensayo clínico adicional evaluó a 302 adultos ≥ 18 años de edad con VIH. VAXNEUVANCE® se administró a 5.630 adultos; 1.241 tenían entre 18 y 49 años de edad, 1.911 tenían entre 50 y 64 años de edad, y 2.478 tenían 65 años de edad o más. De los que recibieron VAXNEUVANCE®, 1.134 fueron adultos inmunocompetentes de 18 a 49 años de edad que no tenían (n=285), 1 (n=620) o ≥ 2 (n=229) factores de riesgo de enfermedad neumocócica y 152 fueron adultos ≥ 18 años de edad con VIH. Además, 5.253 adultos no habían recibido previamente una vacuna antineumocócica y 377 adultos habían sido previamente vacunados con vacuna antineumocócica polisacárida 23 – valente (VPP23) al menos 1 año antes del reclutamiento.
Las reacciones adversas más frecuentemente notificadas tras la vacunación con VAXNEUVANCE® fueron reportadas. En el análisis agrupado de los 7 estudios, las reacciones adversas más frecuentes fueron dolor en el lugar de la inyección (64,6%), fatiga (23,4%), mialgia (20,7%), cefalea (17,3%), hinchazón en el lugar de inyección (16,1%), eritema en el lugar de inyección (11,3%) y artralgia (7,9%) (Tabla 1). La mayoría de las reacciones adversas notificadas fueron leves (según la intensidad o tamaño) y de corta duración (≤ 3 días); las reacciones graves (definidas como un acontecimiento que impide la actividad diaria normal o de tamaño de la reacción en el lugar de la inyección > 10 cm) se produjeron en≤ 1,5% de los adultos a lo largo del programa clínico.
Los adultos de mayor edad notificaron menos reacciones adversas que los adultos más jóvenes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación.
INCOMPATIBILIDADES
En ausencia de estudios de compatibilidad, esta vacuna no se debe mezclar con otros medicamentos.
Antes de administrar VAXNEUVANCE®, consulte la información para prescribir completa.

